颜宁/黄健团队发表最新Cell Research论文,助力抗癫痫/镇痛药物精准设计
来源:生物世界 2025-07-06 14:12
该研究首次揭示了蜘蛛毒素 Phrixotoxin-3(PaurTx3)通过三位点协同调控人源电压门控钠通道 Nav1.6,为多肽类药物设计提供了新思路。
电压门控钠(Nav)通道通过介导膜去极化时钠离子(Na+)的快速内流来控制神经元和肌肉的膜兴奋性。这些功能由核心的 Nav结构驱动,该结构由一个中央孔道结构域(PD)和四个环绕的电压感受结构域(VSD)组成。
在人类的九种 Nav 亚型(Nav1.1 - 1.9)中,由 SCN8A 基因编码的 Nav1.6 在中枢神经系统中广泛表达,尤其在轴突远端起始段的密度极高,其功能紊乱与癫痫等神经疾病密切相关。然而,Nav1.6 虽然功能强大,但靶向药物极少,开发其精准、特异性强的新型分子一直是神经药理领域的一大挑战。

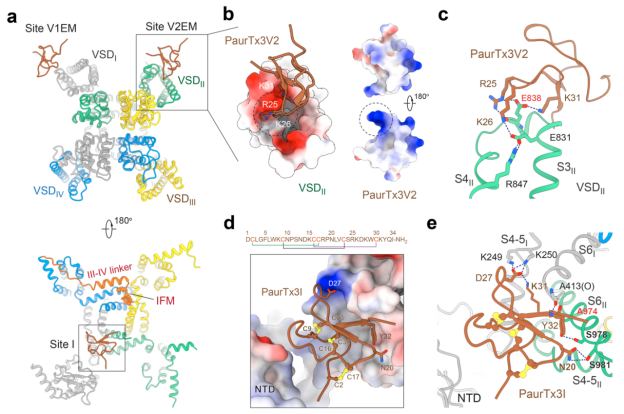
PaurTx3 通过三位点协同调控 Nav1.6 通道
这项研究不仅揭示了毒素多点协同调控 Nav1.6 的机制,还为结构导向的多肽类药物设计带来诸多启发,有望开发靶向 Nav1.6 通道且具有全新作用模式的抗癫痫、镇痛及神经保护药物。
北京生物结构前沿研究中心研究员、深圳医学科学院创始院长、深圳湾实验室主任颜宁和深圳医学科学院特聘研究员黄健为论文共同通讯作者。原普林斯顿大学分子生物学系博士后范潇和清华大学生命科学学院博士后陈娇凤为论文共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


